
 Wasserhärte
Wasserhärte

 Wasserhärte
Wasserhärte
Einer der ersten Werte, die nach Einrichtung neuer Aquarien (oder besser vorher ;) gemessen wird, ist die Wasserhärte.
Sie wird in °dH bzw. mmol/l angegeben und bezeichnet nach DIN 19640 den Gehalt an Erdalkali-Ionen. Die Wasserhärte entsteht durch herauslösen von Mineralien aus den verschiendenen Gesteinsschichten während des Versickerns. Aus diesem Grund hat Regenwasser nur eine geringe bis gar keine Härte.
Aufgrund der Abhängigkeit von der geologischen Struktur des Erdreiches gibt es überall auf der Erde Wasser unterschiedlichster Härtegrade.
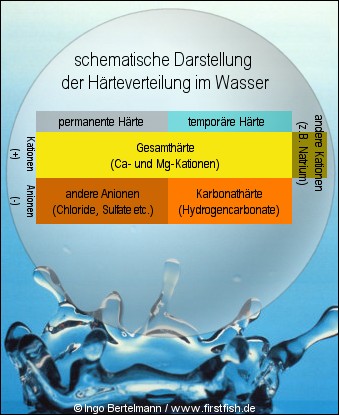
Die Wasserhärte wird unterschieden in
Gesamthärte (GH): Summe aller gelösten Calcium- und Magnesium-Ionen
und Karbonathärte (KH): Summe der gelösten Salze der Calcium- und Magnesium-Ionen, vorrangig die Hydrogenkarbonate.
Gesamthärte
Wie oben gesagt, besteht die GH aus der Summe aller gelösten Erdalkali-Ionen, diese beschränken sich im Süßwasser auf die Calcium- und Magnesium-Ionen. Die weiteren (Beryllium, Strontium, Barium und Radium) kann man aussen vor lassen. Sie kommen wenn, dann nur in Spuren im Meerwasser vor.
Der Härtegrad wird mit folgender Stoffmenge festgelegt:
1°dH entspricht 10mg/l CaO (Calciumoxid = gebrannter Kalk)
Aequivalent dazu lässt sich die Härte noch mit folgenden Stoffmengen berechnen:
1°dH entspricht 7,1 mg/l Ca (Calcium) oder
1°dH entspricht 4,3 mg/l Mg (Magnesium) oder
1°dH entspricht 17,857 mg/l CaCO3 (Calciumkarbonat)
Karbonathärte
Die Karbonathärte spielt in der Aquaristik eine weit aus wichtigere Rolle. Sie besitzt die Fähigkeit, Säuren zu puffern und hilft daher mit, den ![]() pH-Wert zu stabilisieren, man spricht hier von "Säurebindungskapazität". Diese "Säurebindungskapazität bis ph 4,3" ist es im Prinzip auch, die mit den gängigen KH-Titrier-Tests gemessen wird.
pH-Wert zu stabilisieren, man spricht hier von "Säurebindungskapazität". Diese "Säurebindungskapazität bis ph 4,3" ist es im Prinzip auch, die mit den gängigen KH-Titrier-Tests gemessen wird.
Bei der Bestimmung der Karbonathärte wird das Hydrogenkarbonat (HCO3) titriert (= den Titer bestimmen / Titer = Feingehalt an gelöstem Stoff in Grammäquivalenten). Hierbei werden nahezu alle HCO3-Ionen erfasst, nicht nur die von Calcium und Magnesium, sondern auch die von evtl. vorhandenem Natrium, Kalium und dergl., welche aber per Definition eigentlich nicht zur KH gehören.
Die Karbonathärte besteht aus den kohlensauren Salzen des Calciums und des Magnesiums, den Karbonaten, Bikarbonaten und Hydrogenkarbonaten. Hierzu gehören z.B. Kreide, Marmor oder Kalkstein. Diese laugenbildenden Salze kommen im Aquarium fast nur als Hydrogenkarbonat vor und tragen auf folgende Weise entscheidend zur Stabilisierung des pH-Wertes bei.
Hydrogenkarbonate sind gut in Wasser löslich. Dies bleiben sie nur, wenn das Gleichgewicht zu der Konzentration an Kohlendioxid (CO2) ausgewogen ist. Verschiebt sich dieses Gleichgewicht nach unten, sprich, es befindet sich im Wasser nicht mehr genügend freies Kohlendioxid, zerfällt ein Teil des Hydrogenkarbonats zu kaum löslichem Karbonat (Calcit), CO2 und Wasser. Die letzteren beiden reagieren teilweise zu Kohlensäure (H2CO3), damit die verbleibenden Hydrogenkarbonate in Lösung gehalten werden können.

Je größer der CO2-Mangel wird, desto mehr wird über die Hydrogenkarbonate freigesetzt. Ergebnis, die Karbonathärte sinkt, der pH-Wert steigt. Eine geringe KH birgt daher die Gefahr größerer Schwankungen bis hin zum Säuresturz, wenn nahezu alles gelöste Hydrogenkarbonat als Puffer verbraucht wurde.
Ebenso ist das Gegenteil möglich, wenn also zuviel CO2 vorhanden, die KH aber zu gering ist, um diesen Überschuss zu kompensieren, kommt es zu einem schnellen Absinken des pH-Wertes durch ein Zuviel an Kohlensäure (H2CO3).
Ein höherer KH-Wert hält das Wasser daher wesentlich stabiler.
 Aufgrund seiner Puffereigenschaft sollte die Karbonathärte den Wert 5 °dH (1,8 mmol/l) nicht unterschreiten.
Aufgrund seiner Puffereigenschaft sollte die Karbonathärte den Wert 5 °dH (1,8 mmol/l) nicht unterschreiten.
Im Allgemeinen wird für "normale" Aquarien eine Gesamthärte bis 20°dH (3,6 mmol/l) sowie eine Karbonathärte von 5 bis 15°dH (1,8 bis 5,4 mmol/l) empfohlen.
Die Karbonathärte wurde früher auch als temporäre Härte bezeichnet. Hydrogenkarbonate stellen recht lockere Verbindungen dar, die sich z.B. durch Temperaturerhöhung (Kochen) aus dem Wasser entfernen lassen (Ausfällung in Wasserkesseln = Kesselstein).
Als permanente Härte oder Nichtkarbonathärte bezeichnet man dagegen den Teil der Gesamthärte, welcher nicht aus dem Wasser entfernt werden kann, weil er nicht an Hydrogenkarbonate oder Karbonate gebunden ist.
Diese Teile sind meist die mineralsauren Salze wie Chloride, Sulfate, Nitrate und Phosphate, die als Anionen vorliegen. Der Großteil der Nichtkarbonathärte besteht aus Calciumsulfat (Gips), weshalb sie früher als Gipshärte bezeichnet wurde.
Schon seit geraumer Zeit ist der oft noch übliche Begriff "Grad deutscher Härte" mit der Maßeinheit °dH durch den Begriff "Säurebindungskapazität" mit der Maßeinheit mmol/l ersetzt.
Nur durchgesetzt hat sich das bei den meisten Aquarianern irgendwie noch nicht ;)
Umrechnung der Gesamthärte von Deutsche Grad
in die neue Einheit Millimol pro Liter
| °dH GH | mmol/l | °dH GH | mmol/l |
| 1 | 0,18 | 11 | 1,98 |
| 2 | 0,36 | 12 | 2,16 |
| 3 | 0,54 | 13 | 2,34 |
| 4 | 0,72 | 14 | 2,52 |
| 5 | 0,90 | 15 | 2,70 |
| 6 | 1,08 | 16 | 2,88 |
| 7 | 1,26 | 17 | 3,06 |
| 8 | 1,44 | 18 | 3,24 |
| 9 | 1,62 | 19 | 3,42 |
| 10 | 1,80 | 20 | 3,60 |
Umrechnung der Karbonathärte von Deutsche Grad
in die neue Einheit Millimol pro Liter
| °dH KH | mmol/l | °dH KH | mmol/l |
| 1 | 0,36 | 11 | 3,96 |
| 2 | 0,72 | 12 | 4,32 |
| 3 | 1,08 | 13 | 4,68 |
| 4 | 1,44 | 14 | 5,04 |
| 5 | 1,80 | 15 | 5,40 |
| 6 | 2,16 | 16 | 5,76 |
| 7 | 2,52 | 17 | 6,12 |
| 8 | 2,88 | 18 | 6,48 |
| 9 | 3,24 | 19 | 6,84 |
| 10 | 3,60 | 20 | 7,20 |
Umrechnung einzelner Werte bei der KH-Bestimmung
| 1 mmol/l = | 2,78 °dH KH |
| 1 mmol/l = | 61 mg/l HCO3 |
| 1 °dH KH = | 0,36 mmol/l |
| 1 °dH KH = | 21,8 mg/l HCO3 |
| 1 mg/l HCO3 = | 0,016 mmol/l |
| 1 mg/l HCO3 = | 0,046 °dH KH |
(ib)









